Atome,isotope Considérez l’isotope . Cet isotope est composé de...
13 protons 13 électrons 13 neutrons 13 nucléons
Un atome X possède une masse atomique 16 fois plus grande que celle de l’hydrogène , et une charge du noyau 8 fois plus grande. Que peut-on en conclure ?
L’atome X possède 16 protons.
L’atome X est un atome de soufre.
L’atome X possède 8 neutrons.
L’atome X est un atome d’oxygène.
Atome,isotope Si je pouvais ajouter 2 protons et 3 neutrons au ion As, j’obtiendrais du …
S
Atome,nombre de masse Un atome X possède une masse atomique 10 fois plus grande que celle de l’hélium 4He et une charge du noyau 9 fois plus grande. Que peut-on en conclure ?
L’atome X possède 20 protons.
L’atome X possède 40 neutrons.
L’atome X possède 40 nucléons.
L’atome X est un atome de calcium.
Atome,nombre de masse Quelles sont les compositions atomiques des deux isotopes composant le cuivre naturel?
Un des isotopes possède 34 p+ et 29 n, l’autre isotope possède 29 p+ et 34 n
Un des isotopes possède 30 p+ et 33 n, l’autre isotope possède 29 p+ et 36 n
Un des isotopes possède 29 p+ et 34 n, l’autre isotope possède 29 p+ et 36 n
Un des isotopes possède 29 p+ et 35 n, l’autre isotope possède 29 p+ et 37 n
Atome,Rayon atomique Le diamètre d’un atome de brome (Br) est de \(2,2\cdot 10^{-10}\) m. Quel est le diamètre d’un ion ?
\(0,1\cdot 10^{-10}\) m \(1,5\cdot 10^{-10}\) m \(2,2\cdot 10^{-10}\) m \(3,9\cdot 10^{-10}\) m
Atome,Particules Quelle est la charge d’un proton ?
Deux fois celle d’un neutron zéro L’opposé de celle de l’électron
Atome,Nombre de masse,Masse atomique Salut, je suis un exercice! La masse atomique d’un atome est déterminée par…
son nombre d’électrons.
son nombre de neutrons.
son nombre de neutrons et de protons.
son nombre de nucléons.
Atome,Historique Dans l’hypothèse atomique de Dalton, le deuxième point précise que “Tous les atomes d’un élément sont identiques: même poids, mêmes propriétés chimiques”. Ce point est incorrect car...
il existe différents éléments chimiques ayant le même poids.
les atomes d’un élément peuvent former plusieurs allotropes.
les atomes d’un élément n’ont pas tous le même nombre de neutrons.
il existe différents isotopes d’un même élément.
Liaisons,Liaison ionique Le chlorure de sodium est un composé ionique. Cela signifie que... le chlorure de sodium est un composé toxique. le chlorure de sodium est chargé négativement. le chlorure de sodium est composé de ions positifs. le chlorure de sodium est composé d’anions et de cations.
Atome De quoi un atome est-il constitué? D’un noyau très petit et dur autour duquel gravitent des électrons. D’un noyau positif entouré d’électrons négatifs. D’une molécule très petite entourée d’un nuage d’électrons. D’un noyau neutre entouré d’électrons positifs.
Atome De quoi un atome est-il constitué? D’un noyau, lui-même constitué de neutrons et de protons, autour duquel gravitent les électrons D’un noyau, lui-même constitué d’électrons et de protons, autour duquel gravitent les neutrons D’un électron, lui-même constitué de noyaux et de protons, autour duquel gravitent les neutrons
Atome,Particules Les électrons sont... chargés négativement. chargés positivement. neutres.
Atome,Particules Quelles particules trouvent-on dans le noyau d’un atome d’hélium? Des électrons Des protons Des neutrons Des cations
Atome,Particules Sur un atome neutre, le nombre d’électrons est égal... au nombre de protons au nombre de neutrons à la masse de l’atome à la taille de l’atome
Atome,isotope Complétez le tableau ci-dessous:
| l | A | A | A | A | symbole complet & & & &
nombre de protons & 12 & & & 20
nombre d’électrons & 12 & & 10 &
nombre de neutrons & 12 & & 7 & 21
charge & & & &
| l | A | A | A | A | symbole complet & & & &
nombre de protons & 12 & 30 & 7 & 20
nombre d’électrons & 12 & 28 & 10 & 18
nombre de neutrons & 12 & 35 & 7 & 20
charge & 0 & 2+ & &
Atome,isotope Complétez le tableau ci-dessous:
| l | A | A | A | A | symbole complet & & & &
nombre de protons & 16 & & & 13
nombre d’électrons & 16 & & 10 &
nombre de neutrons & 16 & & 8 & 14
charge & & & &
| l | A | A | A | A | symbole complet & & & &
nombre de protons & 16 & 28 & 8 & 13
nombre d’électrons & 16 & 26 & 10 & 10
nombre de neutrons & 16 & 34 & 8 & 14
charge & 0 & 2+ & &
Atome,isotope Complétez le tableau suivant:
| l | A | A | A | A | symbole complet & & & &
nombre de protons & 9 & & 1 &
nombre de neutrons & 9 & & 0 & 18
nombre d’électrons & 9 & & & 18
charge électrique & & & +1 &
| l | A | A | A | A | symbole complet & & & &
nombre de protons & 9 & 12 & 1 & 17
nombre de neutrons & 9 & 13 & 0 & 18
nombre d’électrons & 9 & 10 & 0 & 18
charge électrique & 0 & +2 & +1 &
Atome,isotope Complétez le tableau suivant:
| l | A | A | A | A | symbole complet & & & &
nombre de protons & 17 & & 1 &
nombre de neutrons & 17 & & 0 & 10
nombre d’électrons & 17 & & & 10
charge électrique & & & +1 &
| l | A | A | A | A | symbole complet & & & &
nombre de protons & 17 & 13 & 1 & 9
nombre de neutrons & 17 & 14 & 0 & 10
nombre d’électrons & 17 & 10 & 0 & 10
charge électrique & 0 & +3 & +1 &
Atome,isotope
Combien d’électrons la troisième couche électronique peut-elle contenir? 2 8 12 18
Quel est l’élément le plus abondant dans l’univers? l’hydrogène l’hélium l’oxygène le plomb
Atome,isotope Les éléments de numéros atomiques 1 à 26 sont formés... à l’intérieur des étoiles massives. lors de l’explosion des étoiles massives. par extraction à partir de minerais.
Atome,isotope Les éléments chimiques de numéros atomiques 27 à 92 sont formés... à l’intérieur des étoiles massives. lors de l’explosion des étoiles massives. par extraction à partir de minerais.
Atome,isotope Combien existe-t-il sur terre d’éléments chimiques naturels ? 88 90 92 94
Atome,isotope Combien d’électrons le premier atome de la quatrième période possède-t-il? 6 11 19 22 39
Atome,isotope L’or, le cuivre, l’argent ont été parmi les premiers métaux utilisés par l’homme car... ils ne coûtent pas cher. ils peuvent facilement être extraits de minerais. ils existent sur terre à l’état natif.
Atome,isotope Que peut-on dire du diamètre du ion par rapport à celui de l’atome de sodium métallique Na? il est plus grand il est plus petit les diamètre sont égaux
Atome,isotope A l’état de corps simples, les éléments de la colonne VIII se trouvent sous la forme... d’atomes isolés. de molécules diatomiques. de longues chaînes d’atomes.
Atome,isotope Lors du TP “coloration de flamme”, les couleurs des flammes proviennent... des cations métalliques présents dans la substance à analyser. des liaisons chimiques qui sont rompues lorsque la substance est chauffée. de la fusion des noyaux d’hydrogène présents dans la poudre.
Atome,isotope Combien d’électrons la troisième couche électronique peut-elle contenir? 2 8 12 18
Atome,isotope Combien d’électrons le premier atome de la quatrième période possède-t-il? 6 11 19 22 39
Atome,isotope A l’état de corps simples, les éléments de la colonne VIII se trouvent sous la forme... d’atomes isolés. de molécules diatomiques. de longues chaînes d’atomes.
Atome,isotope Cochez les 6 bonnes réponses (une réponse fausse annule une réponse juste). Un proton est dix fois plus lourd qu’un neutron. Le diamètre de Na+ est plus faible que celui de Na. Un atome de krypton est plus volumineux qu’un atome d’argon. La masse d’un atome dépend du nombre d’électrons externes. La masse d’un atome dépend du nombre de protons et de neutrons. Il est plus facile d’arracher l’électron périphérique de K que celui de Li. Un atome de Na a plus d’électrons périphériques qu’un atome de Cs. L’oxygène est plus électronégatif que le fluor. L’ion Al a 2 couches électroniques occupées. L’atome de soufre est plus léger que l’atome de fluor. Un atome de Fr a un diamètre supérieur à un atome de Rb. Le diamètre de est plus faible que celui de F.
Atome,isotope Un proton est dix fois plus lourd qu’un neutron. Le diamètre de Na+ est plus faible que celui de Na. Un atome de krypton est plus volumineux qu’un atome d’argon. La masse d’un atome dépend du nombre d’électrons externes. La masse d’un atome dépend du nombre de protons et de neutrons. Il est plus facile d’arracher l’électron périphérique de K que celui de Li. Un atome de Na a plus d’électrons périphériques qu’un atome de Cs. L’oxygène est plus électronégatif que le fluor. L’ion Al a 2 couches électroniques occupées. L’atome de soufre est plus léger que l’atome de fluor. Un atome de Fr a un diamètre supérieur à un atome de Rb. Le diamètre de est plus faible que celui de F.
Atome,isotope Parmi les ions suivants, soulignez ceux qui sont stables.
Atome,isotope Parmi les ions suivants, soulignez ceux qui sont stables.
Atome,isotope Parmi les composés ci-dessous, tracez les formules incorrectes. Ecrivez en dessous la formule correcte. ——— CaO ——— ———
Atome,isotope L’hélium est-il à sa place dans la colonne VIII du tableau périodique? Justifiez avec des arguments pour et contre. Arguments pour:
L’hélium possède une couche externe remplie.
L’hélium a des propriétés physiques et chimiques semblables aux autres éléments de la colonne VIII.
Arguments contre:
L’hélium n’a que deux électrons sur sa couche externe (contre 8 pour les autres éléments). De ce point de vue, il devrait être placé en colonne II.
Le remplissage des sous-couches électroniques de l’hélium se termine par des électrons dans une orbitale s. (p pour les autres éléments de la colonne VIII.)
Atome,isotope Représentez selon le modèle de Bohr un atome de phosphore. Représentez selon le modèle de Bohr un atome de soufre.
Atome,isotope Représentez les atomes et ions suivants selon le modèle de Bohr:
N
Ca
Atome,isotope Représentez les atomes et ions suivants selon le modèle de Bohr:
F
K
Atome,isotope On veut observer au laboratoire le spectre d’émission du ion en utilisant la méthode du TP “Coloration de flamme et spectre d’émission”.
Expliquez comment on réalise cette expérience (en pratique).
Expliquez le principe de l’émission (au niveau atomique).
Atome,isotope Lors des travaux pratiques, nous avons utilisé un spectroscope permettant d’analyser la lumière émise par des éléments chimiques. Pourquoi les atomes métalliques placés dans une flamme dégagent-ils de la lumière. Pourquoi le spectre de cette lumière est-il différent pour chaque élément?
Atome,isotope Quel élément parmi Na, S et Ar possède l’énergie de première ionisation la plus faible? Justifiez votre réponse.
Atome,isotope Quel élément parmi Li, O et Ne possède l’énergie de première ionisation la plus faible? Justifiez votre réponse.
Atome,isotope Représentez les atomes et ions suivants selon le modèle de Bohr.
N
Ca
Atome,isotope Représentez les atomes et ions suivants selon le modèle de Bohr.
F
K
Atome,isotope À quels gaz rares correspond la structure électronique des ions suivants ?
Atome,isotope À quels gaz rares correspond la structure électronique des ions suivants ?
Atome,isotope
Atome,isotope Donnez la formule chimique du composé formé avec des atomes de...
brome (Br) et lithium (Li) :
phosphore (P) et magnésium (Mg) :
aluminium (Al) et chlore (Cl) :
Atome,isotope Donnez la formule chimique du composé formé avec des atomes de...
brome (Br) et aluminium (Al) :
azote (N) et calcium (Ca) :
lithium (Li) et chlore (Cl) :
Atome,isotope Trouvez les éléments correspondant aux définitions ci-dessous :
Il possède 4 couches occupées et 4 électrons sur la dernière couche :
Un halogène qui est liquide à 20°C :
Le métal dont les atomes sont les plus légers :
Atome,isotope Parmi les ions suivants, soulignez ceux qui sont stables.
Atome,isotope Parmi les ions suivants, soulignez ceux qui sont stables.
Atome,isotope Décrivez le phénomène d’émission de lumière, en prenant comme exemple l’atome de Na. Faites un schéma et expliquez dans quelles situations cette émission se produit.
Atome,isotope Donnez la configuration électronique des atomes ou ions suivants selon (i) le modèle de Bohr et (ii) le modèle quantique.
Cu
Atome,isotope
Bohr: Quantique: \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^9\)
Bohr: Quantique: \(1s^2 2s^2 2p^6 3s^2 3p^6 \)
Atome,isotope On considère un atome de l’élément brome, Br. En consultant le tableau périodique peut-on en déduire son nombre de protons? neutrons ? électrons? Si oui, indiquez ces nombres. 35 , 35 (si l’atome est neutre), nombre de neutrons variable (plusieurs isotopes du brome)
Atome,isotope On considère un atome de l’élément chlore, Cl. En consultant le tableau périodique peut-on en déduire son nombre de protons? neutrons ? électrons? Si oui, indiquez ces nombres. 17 , 17 (si l’atome est neutre), nombre de neutrons variable (plusieurs isotopes du chlore)
Atome,isotope La théorie atomique proposée par John Dalton comportait les cinq points suivants:
Toute matière est constituée d’atomes indivisibles et indestructibles.
Tous les atomes d’un élément sont identiques: même poids, mêmes propriétés chimiques.
Les atomes d’éléments différents ont des poids différents et des propriétés chimiques différentes.
Les atomes de différents éléments se combinent en rapports de nombres entiers pour former des composés.
Quand un composé est décomposé, les atomes sont inchangés et peuvent reformer le même composé ou un autre composé.
Deux points parmi ces cinq sont erronés. Lesquels, et pourquoi?
Atome,isotope
Pourquoi un atome de soufre et un atome de fer n’ont-ils pas la même masse ?
Dans quel(s) cas deux atomes de soufre peuvent-ils avoir des masses différentes? Quel nom spécifique donne-t-on à ces différents atomes?
Atome,isotope Complétez par un symbole ou un nombre.
| ; |
Atome,isotope Complétez par un symbole ou un nombre.
| ; |
Atome,isotope
A quels éléments appartiennent les atomes possédant?
17 protons, 19 neutrons, 18 électrons?
29 protons, 34 neutrons, 29 électrons?
19 protons, 20 neutrons, 18 électrons?
Atome,isotope Pour chacun des atomes ci-dessus, indiquez s’il s’agit d’un cation ou d’un anion (ou aucun des deux).
chlore, anion
cuivre, aucun des deux
potassium, cation
Atome,isotope
A quels éléments appartiennent les atomes possédant?
11 protons, 12 neutrons, 10 électrons?
26 protons, 30 neutrons, 26 électrons?
35 protons, 45 neutrons, 36 électrons?
Atome,isotope Pour chacun des atomes ci-dessus, indiquez s’il s’agit d’un cation ou d’un anion (ou aucun des deux).
sodium, cation
fer, aucun des deux
brome, anion
Atome,isotope On arrache 2 électrons à un atome de plomb. Qu’obtient-on? (nom précis et notation utilisée) un cation
Atome,isotope On arrache 3 électrons à un atome d’or. Qu’obtient-on? (nom précis et notation utilisée) Un cation
Atome,isotope Qu’est-ce qu’un cation?
Atome,isotope Qu’est-ce qu’un anion?
Atome,isotope Le sodium métallique Na réagit avec l’eau pour former de l’hydroxyde de sodium NaOH et du gaz hydrogène .
Ecrivez l’équation équilibrée de cette réaction:
Répondez par vrai (V) ou faux (F) aux affirmations suivantes:
| V | F | |
|---|---|---|
| Le sodium est un métal alcalin. | ||
| Le sodium est un non-métal. | ||
| Le sodium est un élément de la quatrième période. | ||
| Le sodium cherche à gagner un électron en réagissant avec l’eau. | ||
| L’eau est un métal alcalin | ||
| L’eau est un corps composé |
Atome,isotope Lorsqu’on jette un morceau de sodium dans de l’eau, la réaction dégage beaucoup de chaleur. Cette chaleur provoque l’émission d’une lumière orangée par les atomes de sodium. Expliquez ce phénomène.
| V | F | |
|---|---|---|
| Le sodium est un métal alcalin. | x | |
| Le sodium est un non-métal. | x | |
| Le sodium est un élément de la quatrième période. | x | |
| Le sodium cherche à gagner un électron en réagissant avec l’eau. | x | |
| L’eau est un métal alcalin | x | |
| L’eau est un corps composé | x |
Atome,isotope La chaleur dégagée par la réaction va provoquer l’émission des atomes de sodium (comme lors du TP "coloration de flammes). De l’énergie est donnée aux électrons du sodium, qui peuvent changer de couche électronique. Ils sont alors excités. Lorsqu’ils retournent sur leur couche initiale, ils se débarrassent de l’excès d’énergie en émettant un rayon lumineux. La couleur des rayons émis est propre à chaque élément, et dépend de sa structure électronique. Dans le cas du sodium, la lumière émise est de couleur orange.
Atome,isotope Compléter les phrases en utilisant certains des mots suivants: ion; cation; anion; électron; proton; neutron; isotope; élément; atome; neutre; positif; négatif Tous les d’un même on le même nombre de . Un atome est dit s’il contient le même nombre d’ que de . Si un atome neutre perd des , il devient et on dit que c’est un . Si deux atomes ont les mêmes propriétés chimiques, ils ont le même nombre de et mais le nombre de peut varier, on a alors des différents du même . Tous les d’un même on le même nombre de . Un atome est dit s’il contient le même nombre d’ que de . Si un atome neutre perd des , il devient et on dit que c’est un . Si deux atomes ont les mêmes propriétés chimiques, ils ont le même nombre de et mais le nombre de peut varier, on a alors des différents du même .
Atome,isotope Commentez le graphique ci-dessus. Que représente la valence? Qu’observe-t-on de particulier et pourquoi?
Atome,isotope Décrivez les propriétés chimiques et/ou physiques qui ont permis de placer dans la même colonne les métaux alcalins.
Atome,isotope 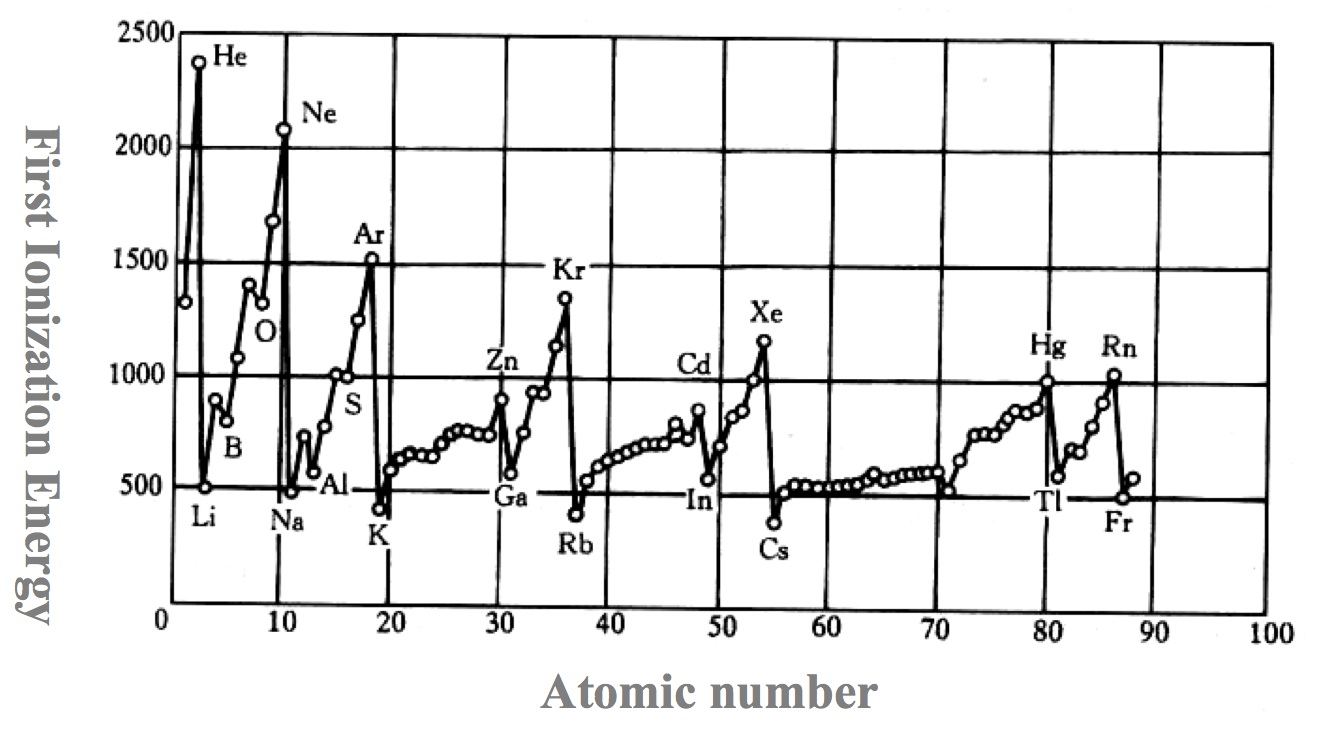 Commentez le graphique ci-dessus. Que représente l’énergie d’ionisation? Qu’observe-t-on de particulier et pourquoi?
Commentez le graphique ci-dessus. Que représente l’énergie d’ionisation? Qu’observe-t-on de particulier et pourquoi?